12月14日,专注于治疗青光眼、角膜疾病和视网膜疾病的新型疗法的眼科医疗技术和制药公司Glaukos Corporation 宣布,美国食品和药物管理局(FDA)批准了其每只眼单次给药iDose® TR(曲伏前列素巩膜内注射剂)的新药申请(NDA)。该药物是一种前列腺素类似物,用于降低眼压过高(OHT)或开角型青光眼(OAG)患者的眼压(IOP)。
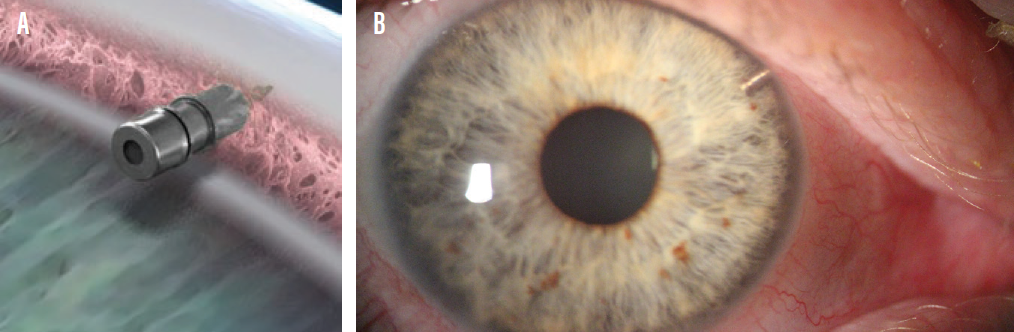
iDose TR 是首创的长效巩膜内程序性药物疗法,可在眼内长时间持续输送 24/7 治疗水平的专利配方曲伏前列素。iDose TR 旨在解决患者普遍存在的不依从性问题以及与青光眼局部用药相关的慢性副作用,从而提高护理标准。
两项 3 期试验均在 3 个月内成功达到了预设的主要疗效终点,并在 12 个月内表现出良好的耐受性和安全性。在前 3 个月中,iDose TR 治疗组的眼压从基线降低了 6.6-8.4 mmHg,而噻吗洛尔对照组降低了 6.5-7.7 mmHg(mmHg 范围代表第 10 天、第 6 周和第 3 个月上午 8 点和上午 10 点这 6 个美国 FDA 预先指定的时间点的眼压降低平均值)。根据这些结果,FDA 在处方信息中得出结论,iDose TR 在头 3 个月的眼压降低效果上不劣于噻吗洛尔眼药水。FDA 还指出,在随后的 9 个月中,iDose TR 并未表现出非劣效性。
在 12 个月时,两项试验中均有 81% 的 iDose TR 受试者完全不再使用降低眼压的局部药物。在这两项试验中,iDose TR 都表现出了极佳的耐受性和受试者保留率,98% 的 iDose TR 受试者在 12 个月后继续参加试验,而噻吗洛尔对照组受试者的保留率为 95%。在对照研究中,2% 至 6% 的 iDose TR 患者报告的最常见眼部不良反应是眼压升高、虹膜炎、干眼症和视野缺损,其中大多数为轻度和一过性不良反应。
iDose TR 还得到了一项 2b 期临床试验积极结果的支持,该结果最近在《药物》(Drugs)杂志的同行评审刊物上作了重点介绍(链接在此)。该研究的作者总结道:"曲伏前列素眼内植入物在单次用药后长达36个月的时间里显示出强劲的降眼压效果,并大大减轻了局部降眼压药物的负担,同时保持了良好的安全性。
FDA的批准是基于两项前瞻性、随机、多中心、双掩蔽、3期关键试验(GC-010 和 GC-012)的结果,这两项试验的目的是比较两种不同曲伏前列素释放率的iDose TR模型(分别称为快释和缓释iDose TR模型)与局部噻吗洛尔眼药水(0. 在降低开角型青光眼或眼压过高受试者的眼压方面,快释和缓释 iDose TR 模型的疗效分别为 0.5% BID(一天两次)和 0.5% BID(一天两次)。3 期试验共在 89 个临床研究机构随机抽取了 1150 名受试者。以下提到的 FDA 批准和 3 期试验数据是针对缓释 iDose TR 型号的,与公司的 NDA 申请和商业化计划一致。
关于iDoseTR
iDoseTR(曲伏前列素巩膜内植入剂)是一种长效前列腺素类似物,获准单次给药,适用于降低开角型青光眼(OAG)或眼压过高(OHT)患者的眼压(IOP)。iDose TR 由医用级钛制成,可通过小梁网和 Schlemm 管后壁直接植入巩膜组织。植入后,75微克不含防腐剂的新型专利配方曲伏前列腺素会通过膜控制扩散持续洗脱到前房,实现全天候药物释放。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。