2024年10月17日,艾伯维 (AbbVie)宣布,美国食品和药物管理局 (FDA) 已批准 VYALEV™ (foscarbidopa和foslevodopa)作为首款也是唯一一款基于左旋多巴的 24 小时皮下注射疗法,用于治疗晚期帕金森病 (PD) 成人患者的运动波动。
支持此次批准的是一项关键性的 3 期 12 周研究,该研究评估了 VYALEV 在晚期帕金森病成年患者中连续皮下注射与口服速释卡比多巴/左旋多巴(CD/LD IR)相比的疗效,以及一项为期 52 周的开放标签研究,该研究评估了 VYALEV 的长期安全性和疗效。
关键研究结果表明,与口服 CD/LD IR 相比,接受 VYALEV 治疗的患者运动波动得到了明显改善,“开 ”的时间延长,没有出现令人烦恼的运动障碍,“关 ”的时间减少。
大多数 VYALEV 不良反应(ARs)并不严重,程度为轻度或中度。最常见的不良反应(大于或等于10%,且高于CD/LD IR发生率)是输液部位事件、幻觉和运动障碍。
帕金森病是一种渐进性慢性运动障碍疾病,由于脑内产生多巴胺的细胞丧失,患者会出现震颤、肌肉僵硬、行动迟缓和平衡困难等症状。当大脑中大约 60-80% 的多巴胺分泌细胞丧失时,帕金森病的运动症状就会开始出现,随着时间的推移,症状会持续缓慢恶化。
随着帕金森病的发展,患者会出现运动和非运动波动以及运动障碍等并发症。晚期帕金森病患者还可能出现运动障碍(不自主运动),这会严重妨碍患者的日常活动。神经元变性和血浆左旋多巴水平波动是这些运动并发症发病的原因,50% 的患者在确诊后 2 至 5 年出现这些症状,约 80% 至 100% 的患者在 10 年后出现这些症状。
关于 VYALEV
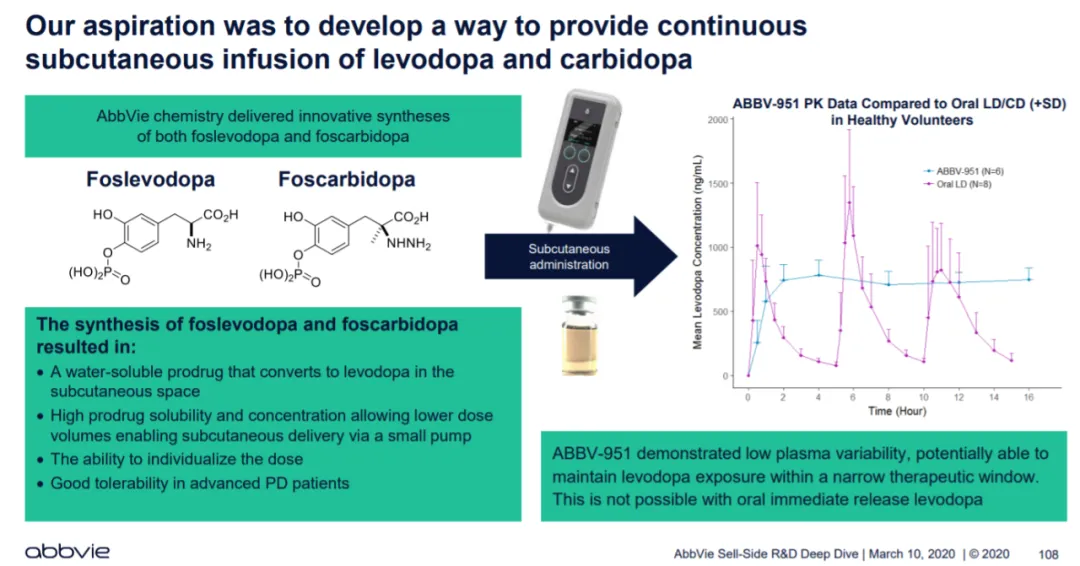
VYALEV(foscarbidopa和foslevodopa)是一种卡比多巴和左旋多巴原药溶液,用于24小时连续皮下注射,治疗晚期帕金森病成人患者的运动波动。VYALEV又名PRODUODOPA,已在35个国家获得批准,全球已有超过4200名患者开始接受治疗。艾伯维将继续与世界各地的监管机构合作,为晚期帕金森病患者提供 VYALEV。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。