近日,Lantern Pharma 宣布,美国食品及药物管理局(FDA)已批准LP-184为治疗胶质母细胞瘤的候选药物。LP-184目前正在进行1A期临床试验,旨在评估这种合成致死性候选研究药物在包括胶质母细胞瘤(GBM)在内的多种实体瘤中的安全性和耐受性。
LP-184 在一定程度上通过 Lantern 的人工智能平台 RADR® 进行了优化和推进,以帮助验证可在临床环境中用于根除具有挑战性的癌症的机制,并揭示目标患者群体的见解。RADR® 是 Lantern 用于癌症疗法发现、开发和抢救的人工智能平台,拥有超过 1000 亿个数据点,有助于开发 Lantern 的产品组合以及与 Lantern 合作者的开发计划。
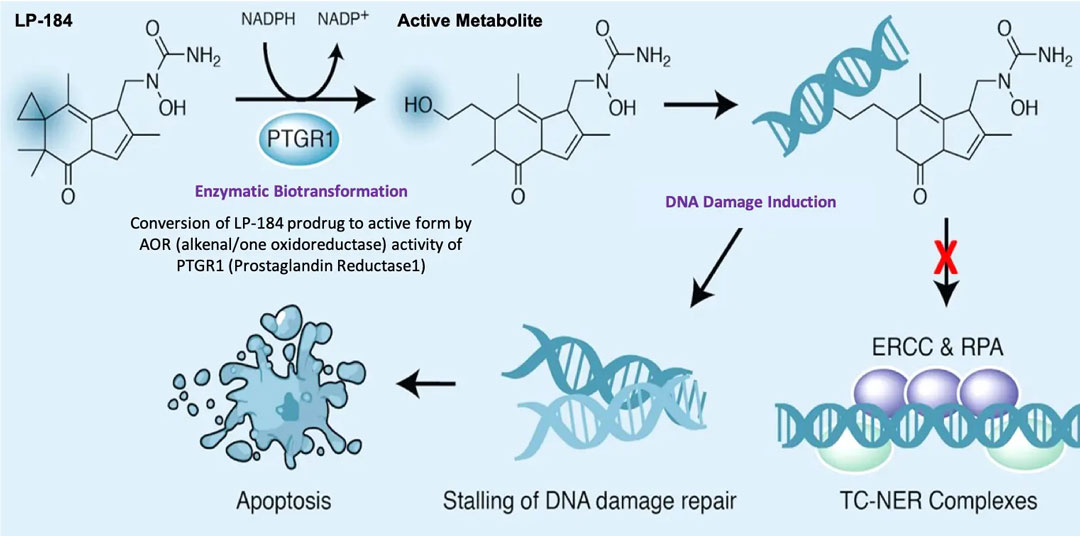
胶质母细胞瘤(GBM)每年影响着美国近 13,000 名患者和全球约 300,000 名患者,死亡率高达 94%。目前的标准疗法导致 GBM 患者的预期寿命不足 15 个月。开发治疗 GBM 的新药的一个主要限制因素是,潜在药物必须能够穿过血脑屏障 (BBB),并且能够抵消 GBM 癌细胞对替莫唑胺(目前治疗 GBM 的标准药物)的固有和适应性抗药性。这种抗药性主要来自 DNA 修复酶 MGMT1 的表达。LP-184 的活性与 MGMT 的表达无关,这意味着它不依赖于 GBM 中 MGMT 的表达不足或过度,并且在两种类型的 GBM 模型中都显示出体内和临床前活性。
二十多年来,没有任何治疗 GBM 的新药获得批准。Lantern Pharma 正在推进 LP-184 的研究,该分子在与导致 DNA 损伤修复缺陷的药物联合使用时显示出合成致死性2 。此外,LP-184 在多个体内模型中显示出它能导致复发性 GBM(rGBM)癌细胞 DNA 的双链断裂,目前正在推进早期临床阶段的研究。
前瞻性陈述
本文包含前瞻性陈述。前瞻性陈述的标志性词语包括"预期"、"应"、“估计”、"可能"、"会"、“将”、“相信”、“将来”、“计划”以及类似表达。前瞻性陈述通常涉及不受本公司控制的风险及不确定性因素,可能导致实际结果与前瞻性陈述的预期结果完全不符。任何人需审慎考虑风险及不确定性因素,不可完全依赖本文的“前瞻性陈述”。本公司声明,无论是否出现最新信息、未来事件或其它情况,本公司均无义务对任何前瞻性陈述进行更新或修改。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。