2024年10月30日,美国食品药品管理局(FDA)已授予Capsida CAP-002 “孤儿药认定”(Orphan Drug Designation,ODD)。CAP-002是该公司的领先基因疗法,用于治疗因合成蛋白结合蛋白1(STXBP1)突变引起的发育性癫痫性脑病(DEE)。CAP-002 是一种新型的、同类首创的静脉注射基因疗法,采用了 Capsida 公司专有的一种工程化囊壳,旨在实现 STXBP1 蛋白在整个大脑神经元的表达,同时显著降低肝脏的靶向性。CAP-002 目前正在进行 IND 许可研究。

目前还没有针对STXBP1发育性癫痫脑病的疾病改变疗法,而CAP-002可能是第一种,为受这种毁灭性疾病影响的患者和家庭带来希望。
STXBP1 蛋白存在于大脑的每一个神经元中,是正常神经传递所必需的。STXBP1 基因突变与耐药性癫痫发作、严重发育迟缓和智力障碍、运动异常以及癫痫猝死(SUDEP)有关。临床前药理学研究证实,通过补充基因可以治疗甚至完全纠正这种疾病。这些研究表明,对这些神经表型的挽救取决于在整个大脑的神经元中补充 STXBP1,其补充水平是野生型血清型(如 AAV9)无法达到的。Capsida 与贝勒医学院神经科学和分子与人类遗传学副教授、Cain 基金会实验室和德克萨斯儿童医院邓肯神经研究所成员薛明山博士合作,利用专有的小鼠疾病模型进行了这些研究。
关于 STXBP1 发育性脑病和癫痫性脑病
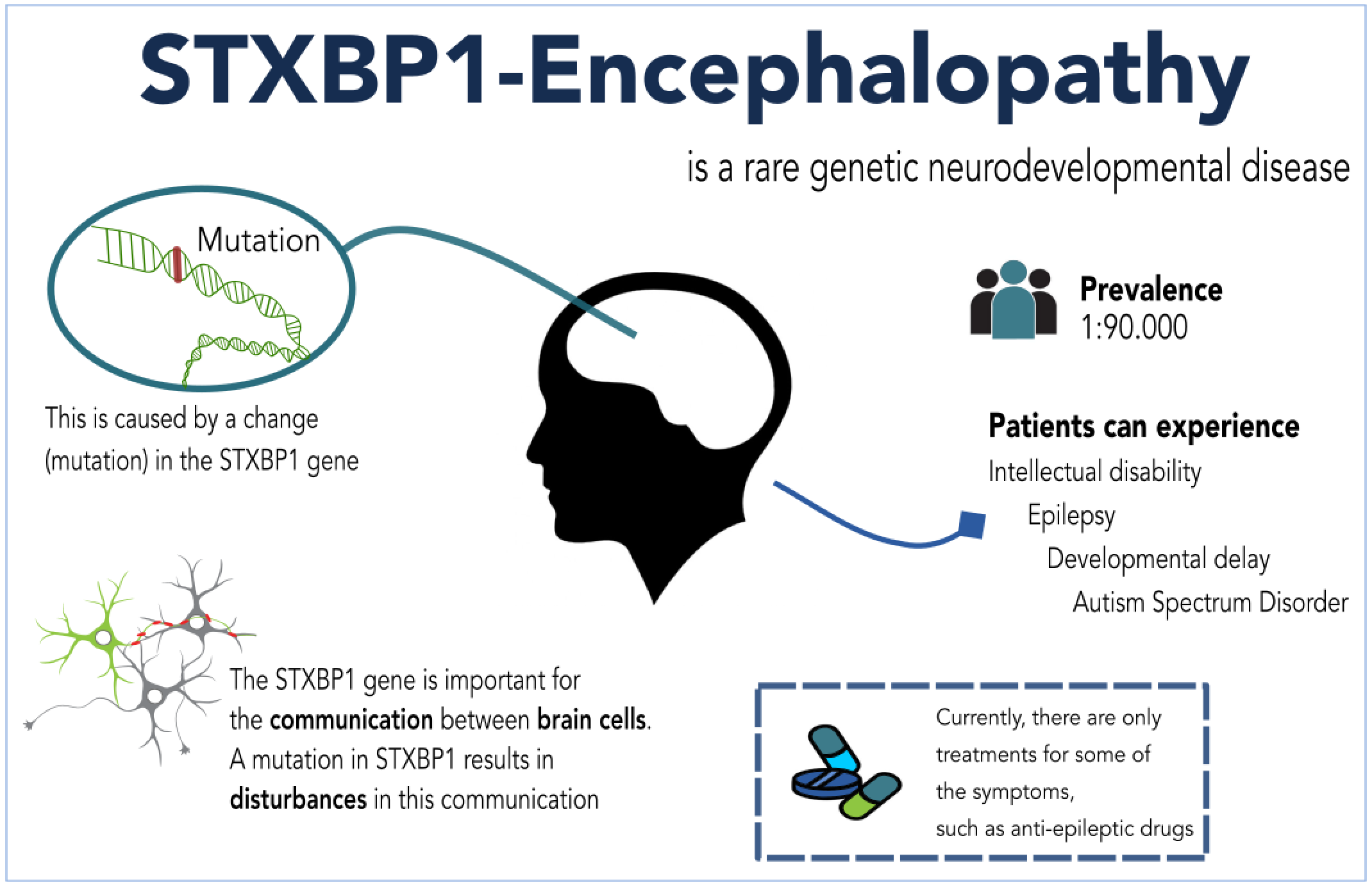
据估计,STXBP1 基因突变导致的发育性和癫痫性脑病在全球每 2.6 万名儿童中就有一人患病。它与耐药性癫痫发作、严重发育迟缓和智力障碍、运动异常以及癫痫猝死(SUDEP)有关。目前还没有获得批准的治疗方法。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。