Novocure公司宣布,美国食品和药物管理局(FDA)已批准Optune Lua®与PD-1/PD-L1抑制剂或多西他赛同时使用,用于治疗使用铂类药物或铂类药物治疗后病情进展的转移性非小细胞肺癌(mNSCLC)成年患者。
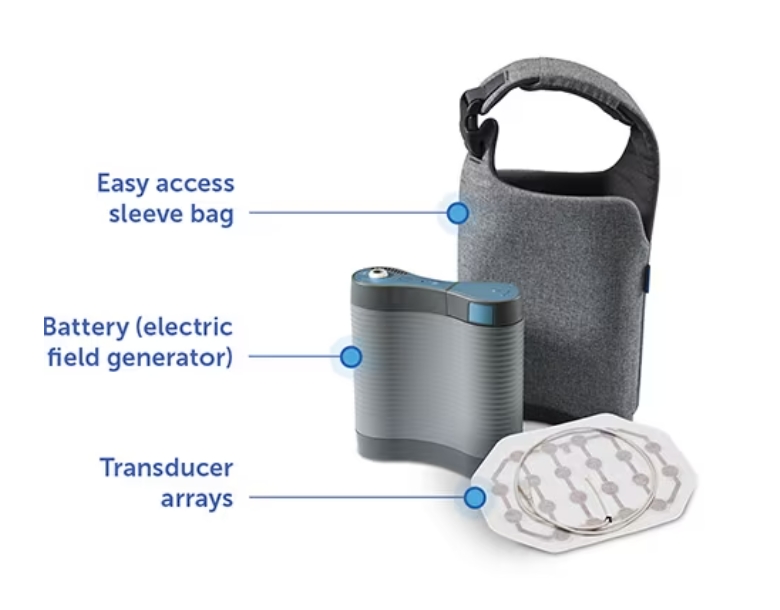
Optune Lua是一种便携式设备,可产生交变电场,即肿瘤治疗场(TTFields),通过非侵入性的可穿戴阵列传递。TTFields对正在分裂的癌细胞的带电成分施加物理力,导致细胞死亡。
支持 Optune Lua 批准的数据
3 期 LUNAR 研究结果表明,Optune Lua与PD-1/PD-L1抑制剂或多西他赛同时治疗的患者(n=145)的中位总生存期(OS)延长了3.3个月(P=0.04),具有统计学意义和临床意义。Optune Lua与PD-1/PD-L1抑制剂或多西他赛同时治疗组的中位OS为13.2个月(95% CI,10.3至15.5个月),而PD-1/PD-L1抑制剂或多西他赛治疗组(n=146)的中位OS为9.9个月(95% CI,8.2至12.2个月)。
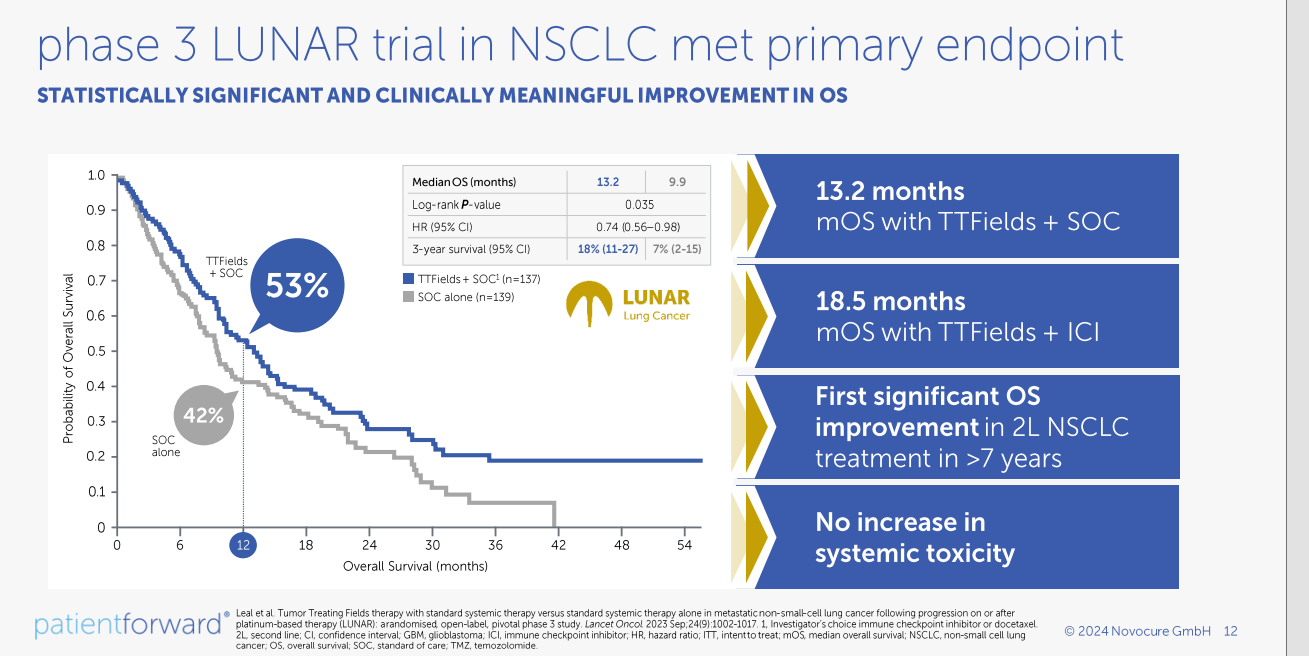
LUNAR研究包括两个预先指定的次要终点。第一个达到统计学意义的次要终点评估了同时接受Optune Lua和PD-1/PD-L1抑制剂治疗的患者与单独接受PD-1/PD-L1抑制剂治疗的患者的中位OS。第二个次要终点评估了Optune Lua与多西他赛同时治疗与单用多西他赛的比较,结果显示出积极趋势,但未达到统计学意义。
随机接受Optune Lua和PD-1/PD-L1抑制剂治疗的患者(70人)的中位OS为19.0个月(95% CI,10.6至28.2个月),而单独接受PD-1/PD-L1抑制剂治疗的患者(71人)的中位OS为10.8个月(95% CI,8.3至17.6个月),中位OS在统计学上显著延长了8.0个月(P=0.02)。
随机接受Optune Lua和多西他赛治疗的患者(75人)的中位OS为11.1个月(95% CI,8.2至13.9个月),而单独接受多西他赛治疗的患者(75人)的中位OS为8.9个月(95% CI,6.5至11.3个月)。中位OS延长2.2个月并没有带来统计学意义上的明显获益,但确实显示出积极的趋势。
63.1%的患者(人数=89)发生了与设备相关的不良事件(AEs),这些不良事件与换能器阵列下的皮肤相关。这些事件大多为低级别(1 - 2 级),只有 4% 的患者(人数=6)出现 3 级皮肤毒性,需要中断治疗。Optune Lua 没有导致 4 级或 5 级毒性反应,也没有导致死亡的设备相关 AE。
各组患者的基线特征非常均衡:中位年龄为65岁(22-86岁);66%为男性,34%为女性;96%的患者ECOG表现为0-1级。83%的患者(83例患者中的69例)在美国的研究机构接受了治疗,四组患者的PD-L1表达数据非常均衡。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。