2024年4月18日,Lumicell宣布,美国食品药品监督管理局(FDA)批准了该公司Lumisight™ (pegulicianine)光学成像剂的新药上市申请(NDA)和Lumicell™直接可视化系统(DVS)的上市前批准(PMA)申请。 统称为 LumiSystem™。
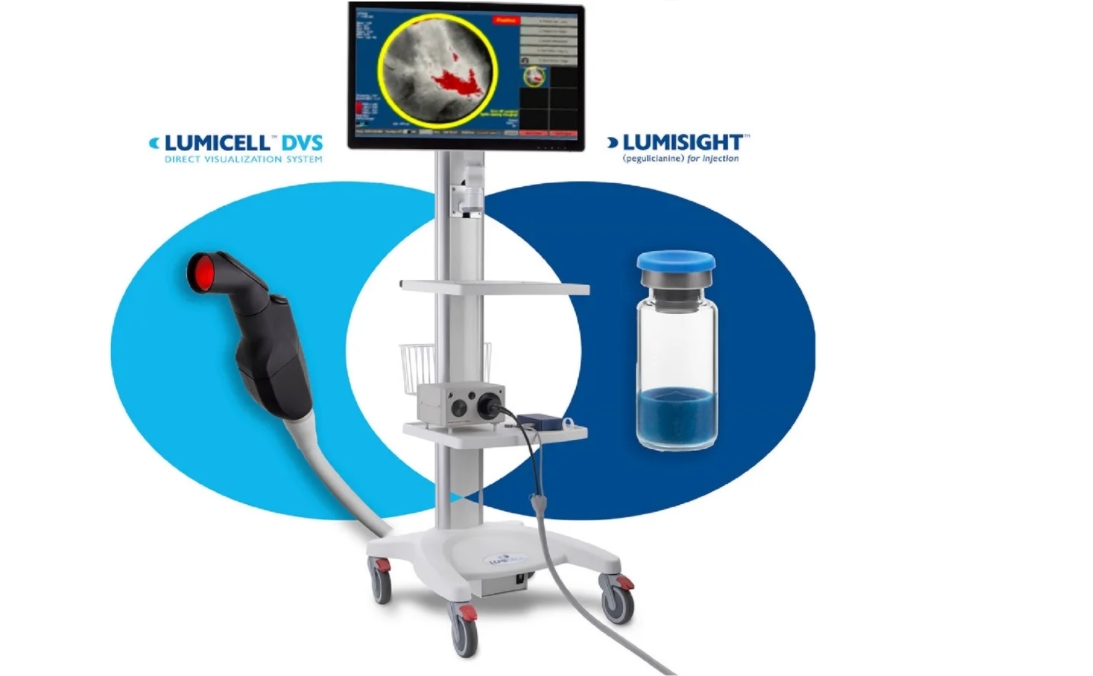
LumiSystem 的诊断准确率为 84%,使外科医生能够在肿块切除术后实时扫描乳腺腔,以检测和切除可能遗漏的残留癌症,从而可能使一些患者免于第二次手术。LumiSystem 组合适用于成人乳腺癌患者的荧光成像,作为在肿块切除术中取出原发标本后术中检测切除腔内癌组织的辅助手段。
Lumicell总裁兼首席运营官Howard Hechler在一份新闻稿中表示:“我们对Lumisight和Lumicell DVS的双重批准感到非常自豪,我们相信这是十多年来第一个获得批准的药物-器械组合产品,遵循FDA最严格的新药申请和上市前批准审查程序。“随着FDA的批准,LumiSystem现在是第一个也是唯一一个能够检测乳腔内最重要的癌组织的成像组合产品。”
2024 年 3 月,FDA 医学影像药物咨询委员会以 16 票对 2 票、1 票弃权的投票结果支持 Lumisight 在保乳手术中检测癌组织方面的获益风险特征。该建议基于对Lumicell DVS使用的显像剂的独立审查,检查了关键的3期INSITE试验(NCT03686215)中包括的350多名患者的疗效数据,以及在学术和社区癌症中心进行的6项研究中招募的700多名患者,包括2期可行性研究(NCT03321929)。
INSITE 是一项前瞻性研究,旨在评估 0 至 III 期乳腺癌患者有或没有 Lumisight 的切缘状态。
在接受 Lumisight 的 357 例患者中,在光学成像剂的引导下,27 例患者(7.6%;95% CI,5.0%-10.8%)在标准肿块切除术后切除后留下的肿瘤得以切除。在这 27 例患者中,有 19 例在标准肿块切除术病理学评估中切缘为阴性,如果没有 Lumisight,残留的癌症将无法识别。
此外,62 例患者 (19.7%) 至少有 1 个阳性切缘。在9例切缘阳性的患者(14.5%)中使用Lumisight避免了第二次手术。
每边缘分析表明,Lumisight 特异性为 85.2%(95% CI,83.7%-86.6%),高于预先设定的 60% 以上的下限目标。值得注意的是,敏感性为49.3%(95%CI,37.0%-61.6%),未能达到预先设定的大于40%的下限目标。
该研究招募了至少 18 岁接受 I 至 III 期浸润性乳腺癌和/或导管原位癌肿块切除术的患者。那些接受新辅助治疗或在先前肿块切除术后接受边缘再切除术的人不允许入组。
患者以 10:1 的比例随机分配到 Lumisight 组或对照组。Lumisight 在手术前 2 至 6 小时进行。值得注意的是,随机化并非旨在提供对照组来评估光学成像剂的性能。每位接受 Lumisight 引导手术的患者作为自己的对照,评估基于标准手术后的最终边缘病理学结合额外的成像引导腔边缘。分配给对照组的人只接受安全性评估。
在研究期间,406 名患者接受了 1.0 mg/kg 的静脉内 Lumisight,然后进行了肿块切除术。在随机分配的 392 名患者中,316 名患有浸润性癌症,76 名患有原位癌。
该研究的主要终点是肿块切除术后 Lumisight 引导的边缘包含残留癌症的患者百分比(成功定义为 95% CI 下限大于 3%);敏感性,或 Lumisight 阳性的肿瘤边缘百分比;和特异性,或无肿瘤的边缘 Lumisight 阴性的百分比。次要终点包括去除 Lumisight 引导边缘后的阳性切缘率以及 Lumisight 引导边缘对切除组织体积的影响。
在安全性方面,在接受 Lumisight 的 367 名患者中观察到蓝色尿液,这是预期的蓝色药物。6 例患者 (1.5%) 因不良反应 (AE) 而停止给药。2 例患者 (0.5%) 报告了与发光相关的严重 3 级 AE,包括超敏反应 (n = 1) 和过敏反应 (n = 1)。
所有其他 AE 都消退了,患者接受了预定的标准肿块切除术。
超敏反应和过敏反应在 Lumisight 的处方信息中以黑框警告标识。在给予 Lumisight 之前,应评估所有患者对造影剂或含有聚乙二醇的产品是否有任何超敏反应史,因为这些患者对显像剂的超敏反应风险可能增加。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。