适应症和用法
早期乳腺癌:
赫赛莱单药适用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的 HER2 阳性早期乳腺癌患者的辅助治疗。
晚期乳腺癌:
赫赛莱单药适用于接受了紫杉烷类和曲妥珠单抗治疗的 HER2 阳性、不可切除局部晚期或转移性乳腺癌患者。患者应具备以下任一情形:
· 既往接受过针对局部晚期或转移性乳腺癌的治疗,或
· 在辅助治疗期间或完成辅助治疗后 6 个月内出现疾病复发。
剂量和给药
为防止用药错误,使用前应检查西林瓶标签,以确保正在制备和使用的药物为赫赛莱(恩美曲妥珠单抗 ),而非曲妥珠单抗。本品仅限于在具有丰富癌症治疗经验的医疗专业人员的监督下使用。
接受本品治疗的患者应确认为 HER2阳性肿瘤,HER2阳性定义为免疫组化(IHC)评分为3+,或原位杂交法(ISH)或荧光原位杂交法(FISH)比率≥2.0。该检测必须在专业实验室进行,以确保结果的可靠性。有关检测性能和解释的完整说明,请参阅相关 HER2 检测分析说明书。
换用其他任何生物药品时需获得处方医生的同意。
本品须由专业医疗人员复溶和稀释,并采用静脉输注给药(参见【用法用量】中的“使用、处理和处置的特殊说明”)。不得静脉推注或快速静脉注射。
给药方案
本品推荐剂量为 3.6 mg/kg,采用静脉输注给药,每 3 周一次(21 天为一个周期)。
给予起始剂量时采用 90 分钟静脉输注。在输注期间应观察患者,并于初始剂量给药后至少 90 分钟内观察发热、寒战或其它输液相关反应。给药期间应密切监测输注部位,防止可能出现皮下外渗的情况(请参见【注意事项】)。
如果既往输注时的耐受性良好,则给予本品的后续剂量时可采用 30 分钟输注,并且应在输注期间和输注后至少 30 分钟内对患者进行观察。
如果患者出现输注相关症状,应减慢本品的输注速率或中断给药(请参见【注意事项】)。出现危及生命的输液反应时,应终止治疗。
治疗持续时间
早期乳腺癌患者应接受共 14 个周期的治疗,除非疾病复发或出现无法控制的毒性。
晚期乳腺癌患者应持续接受治疗,直至疾病进展或出现无法控制的毒性。
给药延迟或漏用
当遗漏一次计划给药时,应尽快给药;切勿等到下次计划周期时给药。同时应调整给药时间表,确保后续给药间隔为 3 周。可按照患者最近一次输注时可耐受的速率进行给药。
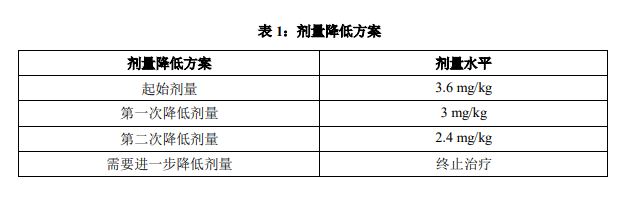
剂量调整
根据表 1 中的指导进行剂量调整。对症状性不良事件的处理可能需要暂时中断给药、降低剂量或终止本品治疗。
降低剂量后,不应再增加本品剂量。
主要成分
活性成份:恩美曲妥珠单抗
恩美曲妥珠单抗是一种靶向 HER2 的抗体-药物偶联物(ADC),含有人源化抗-HER2
IgG1 曲妥珠单抗,该抗体通过稳定的硫醚连接体 MCC(4-[N-马来酰亚胺甲基]环己烷-1-羧酸
酯)与微管抑制药物 DM1(美坦辛衍生物)共价结合。
注意事项
一般情况
接受本品治疗的患者必须通过 HER2 蛋白过表达或基因扩增评估确认 HER2 阳性肿瘤状态。
肺毒性
在本品的临床试验中已报告间质性肺病(ILD)病例,包括非感染性肺炎,某些病例导致急性呼吸窘迫综合征或致命后果(见【不良反应】)。体征和症状包括呼吸困难、咳嗽、疲乏和肺浸润。
建议诊断为 ILD 或非感染性肺炎的患者永久终止本品治疗,但辅助治疗中的放射性肺炎除外,其中对≥3 级或标准治疗无缓解的 2 级患者应永久终止本品治疗(见【用法用量】中的“剂量调整”)。
对于因晚期恶性肿瘤的并发症、合并症和接受同步肺部放疗而存在静息时呼吸困难的患者,其肺部事件的发生风险可能会升高。
肝脏毒性
在临床试验中使用本品治疗时观察到肝脏毒性,其主要表现为无症状性血清转氨酶浓度升高(参见【不良反应】)。转氨酶升高通常为一过性,治疗后第 8 天出现升高峰值, 在下一个周期前恢复至 1 级或更低级别。已观察到本品对转氨酶的累积效应。在大多数病例中,本品末次给药后的 30天内患者转氨酶升高可改善至 1级或正常水平。已在临床试验接受本品治疗的患者中观察到严重的肝毒性,包括肝脏结节再生性增生和某些因药物性肝损伤导致的致死性结果,观察到的病例也可能由已有的合并症和/或已知具有潜在肝毒性的合并用药导致。
在开始本品治疗及后续各次给药前,应监测患者的肝功能。若发生血清转氨酶和/或总胆红素升高,应根据需要降低本品给药剂量或终止治疗(参见【用法用量】)。尚未在开始治疗前血清转氨酶>2.5×ULN 或总胆红素>1.5×ULN 的患者中对本品进行研究。对血清转氨酶>3×ULN 且伴随总胆红素>2×ULN 的患者应永久终止本品治疗。
在接受本品治疗的患者中,已通过肝活检发现肝脏结节再生性增生(NRH)病例。NRH是一种罕见的肝脏疾病,其表现为广泛肝实质良性转化为再生小结节;NRH可能导致非硬化性门脉高压。仅可通过组织病理学确诊 NRH。对于所有在肝脏计算机断层扫描(CT)中观察到门静脉高压症和/或肝硬化样临床症状,但转氨酶无明显升高且无其他肝硬化表现的患者,均应考虑其是否患有 NRH。确诊 NRH 后,必须永久终止本品治疗。
左心室功能障碍
接受本品治疗的患者发生左心室功能障碍的风险增加。在接受本品治疗的患者中曾观察到左心室射血分数(LVEF)下降至<40%,因此症状性充血性心力衰竭(CHF)是潜在风险。应在本品治疗开始前进行标准心脏功能检查(超声心动图或多门控探测(MUGA)扫描),并在治疗期间定期(例如,每三个月)进行复查。在一项真实世界观察性研究(BO39807)中,大约 22%基线 LVEF 为 40-49%的 mBC 患者观察到 LVEF 从基线下降超过 10%,和/或者出现CHF(充血性心力衰竭)事件。这些患者大多数具有心血管危险因素。LVEF 低的 mBC 患者须在仔细评估获益风险后再决定是否给予本品治疗,并应密切监测这些患者的心功能状态。对于eBC 患者,如果在定期监测时发现 LVEF<45%或 LVEF 为 45%~49%且与治疗前的数值相比下降 10%或以上,则暂停本品治疗,并在大约 3 周内重复 LVEF 评估。若 LVEF 未改善或出现进一步下降,应永久性终止本品治疗(参见【用法用量】)。
输液相关反应
尚未在因输液相关反应(IRR)而永久终止曲妥珠单抗治疗的患者中对本品进行研究;因此,不建议此类患者接受本品治疗。
已在本品临床试验中报告了输液相关反应,其表现为以下一种或多种症状:潮红、寒战、发热、呼吸困难、低血压、哮鸣、支气管痉挛和心动过速。一般情况下,上述症状均为非重度症状(参见【不良反应】)。在大多数患者中,上述反应于输注结束后数小时至一天内得到缓解。重度 IRR 患者应中断本品治疗。如果发生危及生命的输液相关反应,则应永久终止本品治疗(见【用法用量】中的“剂量调整”)。
超敏反应
应密切观察患者是否发生超敏反应,尤其是在首次输注期间。在临床试验中进行本品治疗时曾经观察到超敏反应,包括严重的速发过敏样反应。应确保已配备治疗此类反应的药物及抢救设备,以便用于抢救时立即使用。
出血
本品临床试验中已报告相关的出血事件,包括中枢神经系统、呼吸系统和胃肠出血。其中某些出血事件导致致死性结果。在某些观察到的病例中,患者同时接受抗凝治疗、抗血小板治疗,或发生血小板减少症,另一些病例中不存在已知的其他危险因素。应谨慎使用上述影响凝血、血小板的药物,在医学上必需合用时应考虑进行额外监测。
血小板减少症
在本品临床试验中报告了发生血小板减少症或血小板计数降低。上述患者大多数发生 1 级或 2 级事件(≥50,000/mm3),通常在第 8 天血小板计数测得最低值,并且在下一次计划给药前通常恢复至 0 或 1 级(≥75,000/mm3)。临床试验中,亚裔患者血小板减少症的发生率和严重程度较高。
建议在每次给药之前监测血小板计数。接受本品治疗的患者中报告了罕见的重度持续性血小板减少症病例(≥3 级且持续时间超过 90 天的血小板减少症),这些病例中的绝大部分患者合并使用了重组人血小板生成素 (rhTPO)。目前尚未在开始治疗前血小板计数<100,000/mm3 的患者中对本品进行研究。若血小板计数降低达到≥3 级(<50,000/mm3),应暂停本品给药,直至血小板计数恢复至 1 级(≥75,000/mm3)(参见【用法用量】)。对于出现血小板减少症(血小板计数<100,000/mm3)的患者和正在接受抗凝治疗的患者,在本品治疗期间,应该对其进行密切监测。
神经毒性
在本品临床试验中已报告发生周围神经病变,大多为 1 级,且以周围感觉神经病变居多。发生 3 或 4 级周围神经病的患者应暂时终止本品治疗,直至症状缓解至≤2 级。应对患者的神经毒性体征/症状进行实时的临床监测。
外渗
在本品临床研究中,观察到继发于外渗的反应。这些反应通常较为轻微,包括输注部位出现红斑、触痛、皮肤刺激、疼痛或肿胀。通常在输注 24 小时内可观察到这些反应。在上市后用药中,观察到非常罕见的外渗后表皮损伤或坏死病例。目前尚无针对本品外渗的特定治疗。给药期间应对输注部位密切监测,防止可能的皮下外渗情况。
驾驶和使用机器的能力
本品对驾驶车辆和操作机器的能力无影响或几乎无影响。尚不清楚报告的不良反应(如疲乏、头痛、头晕和视物模糊)对驾驶或使用机器能力的影响。应建议出现输液相关反应症状(潮红、寒战性发抖、发热、呼吸困难、低血压或心跳加快)的患者切勿驾驶车辆和操作机器,直至症状减轻。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。
