2024年10月10日,罗氏集团旗下基因泰克宣布,美国食品药品管理局(FDA)批准Itovebi(inavolisib)与palbociclib(Ibrance)和fulvestrant联用,用于治疗成人内分泌抵抗性乳腺癌。美国食品和药物管理局(FDA)今天批准Itovebi(inavolisib)与palbociclib(Ibrance)和氟维司群联用,用于治疗内分泌耐药、PIK3CA突变、激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性、局部晚期或转移性乳腺癌(由FDA批准的检测方法检测)、辅助内分泌治疗后复发或完成辅助内分泌治疗后复发的成人患者。大约40%的HR阳性转移性乳腺癌中存在PIK3CA突变。罗氏表示,Itovebi是一款潜在“best-in-class”的PI3Kα抑制剂。
这一批准得到随机双盲、含安慰剂对照的3期临床试验INAVO120的支持。研究结果表明,在一线治疗中,与单用帕博西尼(palbociclib)和氟维司群相比,基于伊托维比的治疗方案将疾病恶化或死亡风险降低了57%(15.0个月对7.3个月;危险比[HR]=0.43,95% CI:0.32-0.59,p<0.0001),显示了具有统计学意义和临床意义的获益。在进行主要分析时,总生存期(OS)数据尚不成熟,但观察到了明显的积极趋势(分层HR=0.64,95% CI:0.43-0.97,P=0.0338[边界为0.0098])。OS 的随访将持续到下一次分析。
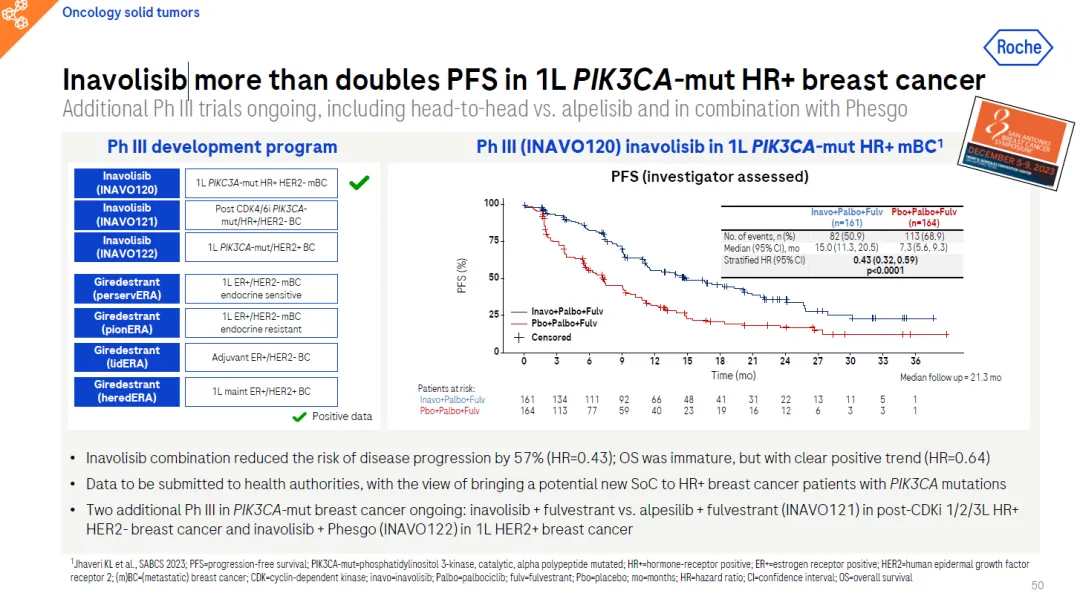
基于INAVO120的研究结果,以Itovebi为基础的治疗方案于2024年5月获得FDA优先审查和突破性疗法认定。INAVO120的数据还被用于向包括欧洲药品管理局在内的其他全球卫生机构提交申请。未来几周,Itovebi 将在美国上市。使用FDA批准的检验方法(如Foundation Medicine公司的FoundationOne®Liquid CDx)进行早期、全面的生物标记物检测,有助于鉴别HR阳性、HER2阴性且存在PIK3CA突变的乳腺癌患者。
目前,Itovebi 正在公司赞助的三项 III 期临床研究(INAVO120、INAVO121、INAVO122)中,以不同的组合治疗 PIK3CA 突变的局部晚期或转移性乳腺癌。
关于激素受体 (HR) 阳性乳腺癌
激素受体(HR)阳性乳腺癌是所有乳腺癌中最常见的类型,约占 70% 的病例。激素受体(HR)阳性乳腺癌的一个显著特点是,其肿瘤细胞具有能与一种或两种激素(雌激素或孕激素)结合的受体,这种受体能促进肿瘤生长。确诊为 HR 阳性的转移性乳腺癌患者往往面临疾病进展和治疗副作用的风险,因此需要更多的治疗选择。PI3K信号通路在HR阳性乳腺癌中普遍失调,通常是由于激活性PIK3CA突变所致,这种突变已被确定为标准护理内分泌疗法联合细胞周期蛋白依赖性激酶4/6抑制剂产生内在耐药性的潜在机制。
关于 Itovebi
Itovebiinavolisib)是一种处方药,与药物palbociclib和氟维司群联合使用,用于治疗激素受体(HR)阳性的成人患者、 人类表皮生长因子受体2 (HER2)阴性乳腺癌,这种乳腺癌的磷脂酰肌醇-3-激酶催化亚基α (PIK3CA)基因异常,并且已经扩散到附近的组织或淋巴结(局部晚期),或身体的其他部位(转移性),并且在接受激素(内分泌)治疗后复发。
内容来自中国SFDA,美国FDA,药品审评中心、国家基本医保目录等权威部门,部分内容来自互联网,如涉及医学知识、观点、建议都不应被视为医生建议或处方诊断,所有信息仅供参考,康和医药不对其承担任何责任,如有错误,版权问题请来电来函告知。